Wie stellt man sich den Erkrankungsprozess vor?
Bei der Mehrzahl der Patienten mit autoimmuner Enzephalitis finden sich sog. Autoantikörper gegen Bestandteile von Nervenzellen. Diese Antikörper werden typischerweise im Liquor (Nervenwasser) und im Serum (Blut) bestimmt und können mit modernen Testverfahren nachgewiesen werden (Diagnostik). Die Autoantikörper werden von Plasmazellen und von B-Lymphozyten produziert (humorale Immunreaktion). Des Weiteren sind bei manchen Erkrankungsprozessen auch T-Lymphozyten von Bedeutung, entweder als mögliche Effektorzellen bei bestimmten Unterformen der Erkrankungsgruppe oder im Zusammenspiel mit den B-Lymphozyten, um eine spezifische Immunreaktion gegen neurale Antigene auszubilden.
Entsprechend der Lokalisation der Zielantigene für die Autoantikörper lassen sich prinzipiell 2 Gruppen des Erkrankungsspektrums unterscheiden (s. auch Abbildung 1):
- Autoimmune Enzephalitiden mit spezifischer Immunreaktion gegen membranständige neurale Antigene. Diese sind überwiegend im Bereich neuronaler Synapsen lokalisiert, die für die Weiterleitung von Nervenimpulsen im zentralen Nervensystem relevant sind und beinhalten v.a. ionotrope und metabotrope Neurotransmitter-Rezeptoren und neuronale Adhäsionsmoleküle. Diese Antikörper haben pathophysiologische Relevanz im Erkrankungsprozess und induzieren jeweils ein typisches Symptombild, was sich aus der gestörten Funktion der Zielantigene ergibt (Dalmau 2017). Studien mit NMDA Rezeptor Antikörpern konnten beispielsweise darlegen, dass es durch die Einwirkung der Antikörper zu einer Verminderung der Oberflächenexpression dieser Rezeptoren kommt. Dies hat direkte Folgen auf die Signalübermittlung der NMDA Rezeptoren und auch nachgeschaltete Prozesse, wie z.B. die neuronale Plastizität werden beeinträchtigt, was ursächlich für typische Erkrankungssymptomen ist (Planaguma 2016, Hughes 2010). Entsprechend finden sich auch bei Patienten mit dieser Erkrankung eine Reduktion der NMDA Rezeptoren im Gehirn. Diese Gruppe der autoimmunen Enzephalitiden spricht in aller Regel gut auf eine Immuntherapie an und das Ziel der Therapie besteht in einer Reduktion der pathogenen Autoantikörper und Depletion oder Beeinflussung der der Antikörper-produzierenden Immunzellen (Therapie).
- Enzephalitiden mit spezifischer Immunreaktion gegen intrazelluläre neuronale Antigene. Diese sind entweder im Zytoplasma oder im Zellkern lokalisiert. Oftmals treten diese Syndrome im Zusammenhang mit Tumorerkrankungen auf, sog. paraneoplastische Erkrankungen. Die spezifischen Antikörper bei diesen Erkrankungen, sog. onkoneurale Antikörper haben in der Regel keine pathophysiologische Relevanz. Bei diesen Erkrankungen scheinen zelluläre Schädigungsmechanismen durch T-Lymphozyten relevant zu sein, die durch zytotoxische Prozesse zu einer Zerstörung der Neurone und zu einer oftmals irreversiblen Schädigung führen. Entsprechend ist das Ansprechen auf Immuntherapie bei Patienten aus dieser Erkrankungsgruppe im Vergleich limitiert, eine schnelle Behandlung eines eventuell zugrunde liegenden Tumors in Kombination mit Immuntherapie ist vordringlich (Therapie).
Des Weiteren gibt es noch Sonderformen autoimmuner Enzephalitiden mit Antikörpern gegen primär intrazellulär lokalisierte Proteine in präsynaptischen Nervenden (z.B. GAD65, Amphiphysin) mit oder ohne Tumorassoziation, die mit verschiedenen Syndromen vergesellschaftet sind (z.B. Epilepsie, Ataxie oder Stiff-Person Syndrom). Hier ist die zugrunde liegende Pathophysiologie der weiterhin unklar, zelluläre und humorale Autoimmunität scheint auch hier eine Rolle zu spielen.
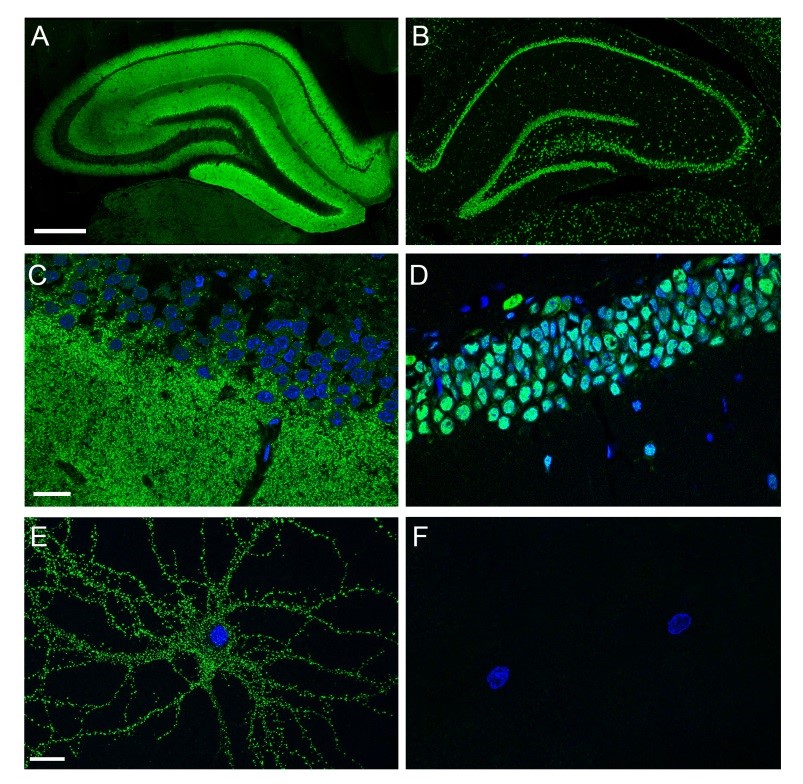
Abbildung 1
Immunhistochemische Unterscheidung von Autoantikörpern, die gegen neuronale Oberflächenproteine (hier NMDA Rezeptor Antikörper, links, A, C, E) oder gegen intrazelluläre Antigene (hier nukleäres Antigen, rechts, B, D, F) gerichtet sind (Gewebeschnitt: Hippocampus aus Rattengehirn A-D; lebende primäre Neurone E und F) Antikörper gegen Oberflächenrezeptoren färben das Neuropil im Hippocampus und binden auch an lebende Neurone, während Antikörper gegen nukleäre Antigene nicht mit lebenden Neuronen interagieren (aus: Dalmau, Geis, Graus, Physiol Rev., 2017)
Neben den seropositiven autoimmunen Enzephalitiden gibt es ein Spektrum klinischer Erkrankungen, bei denen eine zugrundeliegende autoimmune Entzündung der grauen Substanz des zentralen Nervensystems plausibel erscheint, ohne dass bisher spezifische von B-Lymphozyten produzierte Autoantikörper oder T-Lymphozyten nachweisbar sind. Intensive Forschung wird in den nächsten Jahren den Nachweis weiterer Zielantigene erbringen.
Im Gegensatz zu den typischen paraneoplastischen Erkrankungen mit onkoneuralen Antikörpern ist die Pathogenese der Subtypen autoimmuner Enzephalitis mit Oberflächenantikörpern noch unvollständig verstanden. Je nach Subtyp und Zielantigen kann eine mehr oder weniger ausgeprägte Assoziation zu Tumorerkrankungen vorliegen, z.B. nahezu keine Tumorassoziation von Patienten mit LGI1 Antikörper Enzephalitis bis zu einer sehr häufigen Assoziation mit Bronchialtumoren bei Patienten mit GABA-B Rezeptor Enzephalitis. Bei Patienten mit NMDA Rezeptor Enzephalitis können Ovarialteratome vorliegen, die ektopes neuronales Gewebe beinhalten können. In diesen Fällen und in Fällen mit einhergehenden Tumoren kann es dazu kommen, dass die Immuntoleranz aufgehoben wird und neuronale Antigene oder kreuzreagierende Antigene (sog. Molecular Mimicry) von Immunzellen präsentiert werden und so eine spezifische antineuronale Immunantwort induziert wird. Weiterhin können bestimmte Viruserkrankungen nach Schädigung von Gehirngewebe in einem ähnlichen Mechanismus eine sekundäre Immunantwort auslösen, die dann gegen neuronale Antigene, z.B. den NMDA-Rezeptor gerichtet sind (Armangue 2018) (s. auch Abbildung 2).
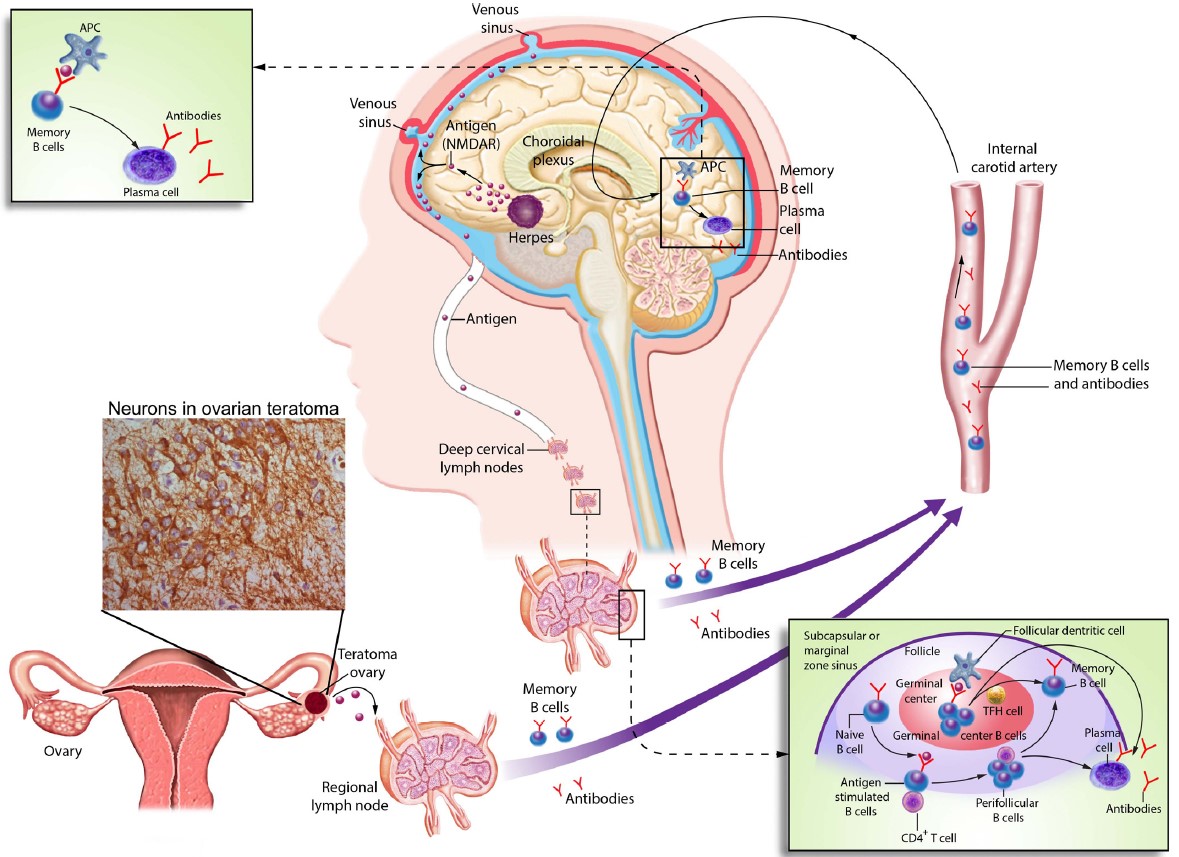
Abbildung 2
Mögliche Trigger autoimmuner Enzephalitiden, hier dargestellt am Beispiel der NMDA Rezeptor Enzephalitis. Ektopes neuronales Gewebe in einem Tumor (hier Ovarialteratom) oder zerstörtes Gehirngewebe z.B. nach einer Herpesenzephalitis kann eine periphere Immunantwort, z.B. in den Lymphknoten induzieren. Antigenpräsentierende Zellen können unter Interaktion mit MHC Klasse II Molekülen und CD4+ T-Zellen B-Lymphozyten aktivieren. Dadurch können sog. Memory-B-Zellen und schließlich Antikörper-produzierende Plasmazellen gebildet werden. Plasmazellen sowie aktivierte B-Zellen können das zentrale Nervensystem erreichen und eine zentrale Immunantwort mit lokaler Antikörper-Bildung hervorrufen (aus: Dalmau, Geis, Graus, Physiol Rev., 2017).
Literatur
- Dalmau, J., Geis, C., and Graus, F. (2017) Autoantibodies to Synaptic Receptors and Neuronal Cell Surface Proteins in Autoimmune Diseases of the Central Nervous System. Physiol Rev 97, 839-887
- Planaguma, J., Haselmann, H., Mannara, F., Petit-Pedrol, M., Grunewald, B., Aguilar, E., Ropke, L., Martin-Garcia, E., Titulaer, M. J., Jercog, P., Graus, F., Maldonado, R., Geis, C., and Dalmau, J. (2016) Ephrin-B2 prevents N-methyl-D-aspartate receptor antibody effects on memory and neuroplasticity. Ann Neurol 80, 388-400
- Hughes, E. G., Peng, X., Gleichman, A. J., Lai, M., Zhou, L., Tsou, R., Parsons, T. D., Lynch, D. R., Dalmau, J., and Balice-Gordon, R. J. (2010) Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. J Neurosci 30, 5866-5875
- Armangue, T., Spatola, M., Vlagea, A., Mattozzi, S., Carceles-Cordon, M., Martinez-Heras, E., Llufriu, S., Muchart, J., Erro, M. E., Abraira, L., Moris, G., Monros-Gimenez, L., Corral-Corral, I., Montejo, C., Toledo, M., Bataller, L., Secondi, G., Arino, H., Martinez-Hernandez, E., Juan, M., Marcos, M. A., Alsina, L., Saiz, A., Rosenfeld, M. R., Graus, F., Dalmau, J., and Spanish Herpes Simplex Encephalitis Study, G. (2018) Frequency, symptoms, risk factors, and outcomes of autoimmune encephalitis after herpes simplex encephalitis: a prospective observational study and retrospective analysis. Lancet Neurol 17(9), 760-772



