Die Struktur des Netzwerkes
Das Deutsche Netzwerks zur Erforschung der autoimmunen Enzephalitis setzt sich aus einem zentralen nationalen Patienten/innen-Register als Basis klinischer Forschung und einzelnen grundlagenwissenschaftlichen Arbeitsgruppen zusammen, die sich inhaltlich ergänzen. Das Netzwerk besteht gegenwärtig aus über 100 Zentren.
Das GENERATE-Netzwerk wird durch den eingetragenen gemeinnützigen Verein GENERATE e.V. ergänzt, der im Januar 2017 in Wien gegründet wurde. Mit der Gründung eines eingetragenen Vereins ist das bestehende Netzwerk GENERATE verselbständigt und als zentrale Einrichtung und Ansprech- sowie Kooperationspartner für Forschende, ärztliches Personal, Betroffene und deren Organisationen.
Übergeordnetes Ziel des Netzwerks ist es, die Diagnostik, Therapie und Versorgung von Patientinnen und Patienten mit Autoimmunenzephalitiden zu verbessern. Es ist davon auszugehen, dass es zahlreiche weitere, bislang unerkannte Zielantigene bei Patienten/innen mit Autoimmunenzephalitiden gibt. Des Weiteren ist die zugrunde liegende Pathophysiologie und die Entstehung dieser Erkrankungen bislang nur ansatzmäßig verstanden. Um eine weitere Verbesserung der Früherkennung und die Entwicklung möglichst spezifischer Therapieansätze weiter voranzutreiben, gibt es im Netzwerk ein enges Zusammenspiel und zahlreiche Überlappungen klinisch orientierter und grundlagenwissenschaftlicher Arbeitsgruppen in den teilnehmenden Zentren. So soll gewährleistet werden, dass neue Erkenntnisse bezüglich diagnostischer und therapeutischer Verfahren schnell umgesetzt werden können.
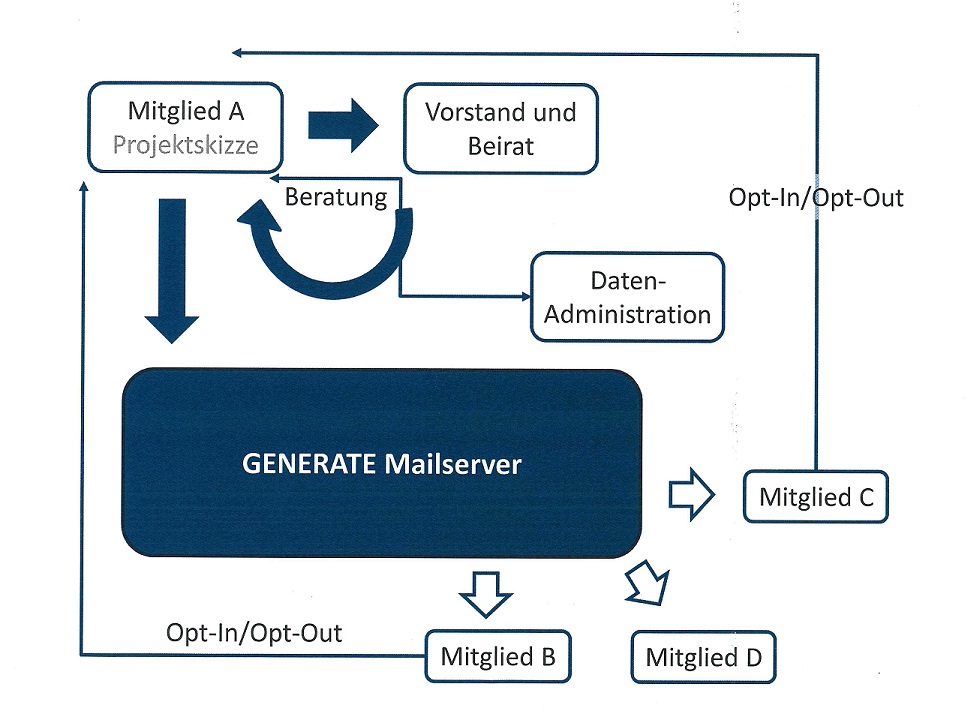
Das GENERATE Netzwerk ist ein Forschungs-initiiertes, klinisches und wissenschaftliches Netzwerk. wissenschaftliche Projekte werden von GENERATE Mitgliedern vorgeschlagen und nach einer Prüfung durch den Vorstand über den GENERATE-Mailverteiler an die teilnehmenden Zentren kommuniziert. Die Zentren entscheiden nach dem Opt.-In/Opt-out über Ihren Beitrag (siehe folgende Grafik).
Strukturierte Abläufe bei Projektvorschlägen:
Im Folgenden finden Sie Kurzbeschreibungen der Forschungsprojekte der einzelnen klinischen- und grundlagenwissenschaftlichen Gruppen.
Langzeitverlauf von NMDA-, LGI1-, CASPR2- und GAD-Antikörper-assoziierter Autoimmunenzephalitis und Therapieansprechen auf Rituximab
Nach wie vor fehlen Langzeitdaten zu Prognose und Outcome von Autoantikörper-assoziierten Enzephalitiden unter Immuntherapie mit Rituximab. Es ist nicht bekannt wie viele Patientinnen und Patienten in Deutschland damit behandelt werden und wie das Ansprechen auf diese Therapie ist. Zielsetzung: Es soll eine Analyse des Langzeitverlaufs von Patientinnen und Patienten mit NMDA-, LGI1/ CASPR2- und GAD-Antikörper-assoziierter limbischer Enzephalitis unter einer Therapie mit Rituximab und ein Vergleich zu anderen Therapien erfolgen. Methodik: Retrospektive Analyse der in GENERATE erhobenen Patienten/innendaten mit einem Beobachtungszeitraum von mindestens 24 Monaten.
Dr. Franziska Thaler (LMU München) Dr. Luise Röpke (Uni Jena), Dr. Christine Strippel (UKM Münster), PD Dr. Nico Melzer (UKM Münster), Prof. Dr. Tania Kümpfel (LMU München), Prof. Dr. Klaus-Peter Wandinger (UKSH Lübeck), Prof. Dr. Frank Leypoldt (UKSH Kiel)
Visuelles Arbeitsgedächtnis bei anti-NMDA-Rezeptor-Enzephalitis
Rekurrente glutamaterge Neurotransmission am NMDA Rezeptor spielt eine entscheidende Rolle in der Aufrechterhaltung von Gedächtnisinhalten. Mittels funktionellem MRT wollen wir die gedächtnisbezogene Aktivierung während einer visuellen Arbeitsgedächtnisaufgabe bei Patienten/innen mit anti-NMDAR Enzephalitis unter-suchen. Eingeschlossen werden Patientinnen und Patienten mit anti-NMDAR-Enzephalitis bis 6 Monate nach Entlassung aus dem Akut-Krankenhaus.
Prof. Dr. med. Carsten Finke (Charité Berlin NeuroCure)
Overlap MS-LE/TLE-AE
Klinisches Projekt zur möglichen autoimmunen Genese der TLE-AE bzw. seronegativen LE. Overlap zwischen klinischer relapsierender oder progredienter Multipler Sklerose mit typischen MR-Läsionen und einer klinischen Temporallappenepilepsie mit für LE typischen MR-Veränderungen. Einschlusskriterien: Multiple Sklerose gemäß den revidierten Kriterien von 2017 sowie seronegative Limbische Enzephalitis gemäß Graus et al. 2016.
PD Dr. Nico Melzer (UKM Münster)
Genetische Prädisposition der (auto-)immunen Enzephalitis mit GAD65 Autoantikörpern
Assoziation von HLA-Merkmalen und anderen genomischen Markern mit autoimmuner Enzephalitis mit GAD65-Autoantikörpern (Limbische Enzephalitis, Cerebellitis, Stiff-Person-Syndrom) im Vergleich mit dem Typ1 Diabetes mellitus und anderen Enzephalitis Subgruppen (anti-NMDA-R Enzephalitis, anti-LGI1 Enzephalitis). Patientinnen und Patienten mit autoimmuner Enzephalitis mit GAD65 Autoantikörpern. Fallzahlanalyse n=100 anti-GAD65 Enzephalitis; Vergleichsgruppe anti-NMDA-R Enzephalitis (n=166, bereits sequenziert) und anti-LGI1 Enzephalitis (n=75, bereits sequenziert); Kontrollgruppe >1300 gesunde Kontrollen (bereits sequenziert).
Dr. Christine Strippel (UKM Münster), Prof. Dr. Frank Leypoldt (UKSH Kiel), Prof. Dr. Monika Stoll (UKM Münster), PD Dr. Nico Melzer (UKM Münster)
Autoimmune Enzephalitis mit GAD-Antikörpern: Häufigkeit, klinische Symptomatik und Therapie-response - eine GENERATE-Studie (GAD-GENERATE)
Ziel des Projektes ist die systematische Charakterisierung aller im GENERATE-Netzwerk eingeschlossenen Patientinnen und Patienten mit GAD-AIE durch eine retrospektive Erhebung der klinischen Daten von Patienten/innen mit GAD-AIE aus der GENERATE-Datenbank.
Dr. Marie Madlener (UKM Münster), PD Dr. Nico Melzer (UKM Münster), PD Dr. Michael Malter (UK Köln)
Effektivität der Immuntherapie beim Iglon5-Syndrom: retrospektive Datenanalyse
Evaluation der Effektivität von Immuntherapien beim Iglon5 Syndrom in Abhängigkeit vom Zeitpunkt des Therapiebeginnes und der angewendeten Therapie bzw. im Vordergrund stehender klinischer Symptomatik.
Dr. Thomas Grüter, PD Dr. Ilja Ayzenberg (St. Josef Hospital Bochum)
Anti-NMDA-Rezeptor assoziierte Enzephalitis und Multiple Sklerose
Im Rahmen des Projektes werden klinische und bildgebende Veränderungen bei NMDARE/MS-Overlap-Patienten charakterisiert und mit Manifestationen bei klassischen NMDARE-Patienten verglichen. Konkret werden u.a. untersucht: Unterschiede in demographischen Faktoren und klinischen Manifest-ationen; Assoziation zu Auto-Ak, insbes. AQP4 und MOG; Unterschiede in Liquorparametern; Frequenz und Cha- raktaristika von Läsionen der weißen Substanz und hirn- atrophische Veränderungen im klinischen Routine-MRT; Schädigung der weißen Substanz und volumetrische Ver- änderungen im 3T-Forschungs-MRT; Untersuchung der Läsionscharakteristika (zB. central vein) im 7T-MRT. Untersuchung der Assoziation von MRT-Veränderungen mit klinischen und kognitiven Maßnahmen.
PD Dr . med. Jan Lewerenz (UK Ulm)
Prof. Dr. med. Carsten Finke (Charité Berlin)
Liquid Biopsy bei immuntherapie-naiver, „tumor-negativer“ paraneoplastischer neurologischer Erkrankung mit onco-neuralen Autoantikörpern
Lassen sich einzelne zirkulierende Tumorzellen („Liquid Biopsy“) bei „Tumor-negativen“ Patientinnen und Patienten mit neu diagnostizierter PND mit eindeutigem Nachweis onco-neuraler Autoantikörper verlässlich isolieren? Gelingt es nach der Isolation zirkulierender Tumorzellen über molekulare Analysen die Art des zugrunde liegenden Tumors zu diagnostizieren Lässt sich auf der Basis der Befunde eine auf den Tumorzellnachweis abgestellte personalisierte onkologische Therapie begründen und führt diese möglicherweise zu einer Remission der PND? Einschlusskriterien: Immuntherapie-naive, „Tumor-negative“ Patient/innen mit PND mit eindeutigem Nachweis onco-neuraler Autoantiköper.
PD Dr. Dr. Oliver M. Grauer, Dr. Christine Strippel (UKM Münster), Prof. Dr. Christoph Klein (UK Regensburg), PD Dr. Nico Melzer (UKM Münster)
Epileptische Anfälle und Prodromalsyndrome bei Antikörper-assoziierten autoimmunen Enzephalitiden: Häufigkeit und Semiologie
Epileptische Anfälle sind zwar ein häufiges Symptom autoimmuner Enzephalitiden (AIE) (Graus et al., 2016), über die spezifische Häufigkeit und Semiologie epileptischer Anfälle bei den einzelnen Subformen von AIE liegen nur wenige systematische Untersuchungen vor. Fallberichte zeigen, dass bei AIE unterschiedliche Formen von epileptischen Anfällen auftreten können. Bei der Anti-LGI1-Enzephalitis können faziobrachiale dystone Anfälle (FBDS) aber auch isolierte Temporallappenanfälle auftreten. Auch innerhalb der Gruppe der Temporallappenanfälle werden dabei unterschiedliche Anfallsmanifestationen beobachtet. Wiederholt wurden z.B. Anfälle mit einer pilomotorischen Symptomatik („Ausbildung einer Gänsehaut“) beschrieben, wobei diskutiert wird, ob dieser Anfallstyp ein spezifisches klinisches Merkmal besonderer Verlaufsformen einer AIE ist (Rocamora et al., 2014).
Dr. Albrecht Kunze, Dr. Tillmann Fritzel, Prof. Dr. Christian Geis (UK Jena), PD Dr. Michael Malter (UK Köln)
ZNS Infektionen und Autoimmunenzephalitiden (EBV)
Aus dem Patient/innen-Kollektiv mit Autoimmunenzephalitiden des GENERATE Netzwerkes sollen in Liquor- und Serumproben Antikörper gegen den Epstein-Barr Virus gemessen und die intrathekale Antikörperproduktion bestimmt werden. Zudem soll analysiert werden, ob sich das Outcome 1 Jahr nach Erkrankungsbeginn zwischen ASI positiven und ASI negativen Patientinnen und Patienten unterscheidet. Gemessen werden VCA und EBNA IgG in Liquor und Serum mittels ELISA (Serion ELISA). Dieser Teil des Projekts erfolgt in Kooperation mit Jan Lewerenz (Ulm) und Peter Lange (Göttingen). Neben Bestimmung der ASI erfolgt eine Korrelation des Titers mit dem Verlauf und der Vergleich mit gematchten Kontrollproben aus Kontrollproben der Biobank in Hannover und Ulm.
PD Dr. med. Kurt-Wolfram Sühs, Dr. Philipp Schwenkenbecher (MHH Hannover)
Identifizierung der ersten Ereignisse bei Autoimmunenzephalitis: Plasmazellhandel und B-Zell-Rezeptor-Repertoire bei Autoimmunenzephalitis
Ziel der Studie ist die rekombinante Herstellung monoklonaler humaner Autoantikörper aus dem Blut und Liquor von Patientinnen und Patienten mit einer gesicherten Autoimmunenzephalitis. Durch den Vergleich der klonalen Expansion, der Antikörper-Isotypen, der Verteilung von Antikörper-Familien im Liquor- und peripheren Kompartment und durch die Beschreibung der Antikörper-Charakteristika soll es gelingen, die Entstehung und Entwicklung des Enzephalitis-spezifischen Autoantikörper-Repertoires zu verstehen. Für die Studie ist die Kryokonservierung und Asservierung von Liquorzellen und PBMCs erforderlich, die Proben werden nach Berlin oder Düsseldorf verschickt und dort aufgearbeitet. Eingeschlossen werden männliche oder weibliche Patienten jeden Alters mit dem klinischen Syndrom einer Autoimmunenzephalitis und dem Nachweis eines Autoantikörpers im Liquor und/oder Serum gegen ein etabliertes Autoantigen (u.a. NMDA-, GABAa-, GABAb-, AMPA-, mGluR5-Rezeptor, LGI1, Caspr2).
PD Dr. med. Harald Prüss (Charité Berlin), Prof. Dr. med. Norbert Goebels (UK Düsseldorf)
Untersuchung von Mechanismen des neuronalen Netzwerks und Verhaltensstörungen bei Autoimmunenzephalitis
Ziel des Projekts ist es, pathologische Netzwerkmechanismen im Hippocampus zu identifizieren, die durch Antikörper gegen die GluN1 Untereinheit des NMDA Rezeptors bedingt werden. Hierzu verwenden wir etablierte passiv-Transfer Mausmodelle und verschiedene elektrophysiologische Untersuchungsmethoden in akuten Hippocampus Gehirnschnittpräparaten. Für die Untersuchungen werden sowohl Antikörper aus Patientenliquor sowie rekombinante Antikörper gegen die GluN1 Untereinheit eingesetzt. Für diese und andere Projekte suchen wir im GENERATE-Netzwerk Liquorproben von Patientinnen und Patienten mit NMDA Rezeptor, LGI1, AMPA Rezeptor und GABA B Rezeptor Antikörpern.
Prof. Dr. Christian Geis (UK Jena)
Anwendung fortgeschrittener Längsstruktur-MRT-Analysen bei Autoimmunenzephalitis
Ziel dieses Teilprojekts ist es, die Häufigkeit und Eigenschaften der Hirnläsion, die Atrophie des Gehirns und die Läsionsmerkmale bei Überlappungssyndromen in ihrer Längsschnittentwicklung als Biomarker bei Patientinnen und Patienten mit AE unter Verwendung verfügbarer klinischer Datensätze und fortschrittlicher bildgebender Methoden mit ultra-hochfeld-MRT zu analysieren. Dies wird dazu beitragen, Behandlungsentscheidungen zu leiten, die Beratung zu verbessern und die zugrunde liegenden Mechanismen der Läsionsbildung und Hirnatrophie bei Patienten/innen mit AE zu verstehen. Einschlusskriterien: Routine-MRTs aus GENERATE-Zentren von Patientinnen und Patienten mit NMDARE und LGIE + Patienten mit Overlap-Syndrom: klinische Beschreibung + Vor-MRTs + Einladung der Patientinnen und Patienten nach Berlin zum 7T-MRT .
Prof. Dr. med. Carsten Finke (Charité Berlin NeuroCure), Dr. med. Michael Scheel (Charité Berlin), Prof. Dr. med. Thorsten Bartsch (UKSH Kiel)
Einsatz von intravenösen Immunglobulinen bei Patienten mit Antikörper assoziierter Autoimmunenzephalitis
Bei welchem Anteil von Patientinnen und Patienten mit Autoantikörper assoziierter Enzephalitis erfolgt eine Behandlung mit IVIG in der Akutphase? Inwieweit korreliert das Outcome der IVIG Gabe in der Akutphase? Besteht ein Zusammenhang zu Zeitpunkt, Vortherapie, Dosierung und Frequenz der IVIG Gaben? Eingeschlossen werden Patienten und Patientinnen mit Autoimmunenzephalitis und Nachweis entsprechender Antikörper (NMDA, LGI1, CASPR2, AMPA, GABAb, GAD) im Liquor und/oder Serum. Beobachtungszeitraum der Patient/innen mindestens 12 Monate nach Erkrankungsbeginn.
PD Dr. med. Kurt-Wolfram Sühs, Dr. med. Dominica Ratuszny, Prof. Dr. med. Martin Stangel (MHH Hannover)
Überprüfung der von Graus et al. vorgeschlagenen Diagnosekriterien an den Patienten der GENERATE-Kohorte (KritValid)
Basierend auf Charakteristika der eigenen Patientinnen und Patienten, Literatur und Expertenmeinungen haben Graus et al. (The Lancet 02/2016) Kriterien zur Diagnose einer Autoimmunenzephalitis (AE) entwickelt. Es wird dabei zwischen „possible autoimmune encephalitis“ (Eingangskriterien) und „definite autoimmune encephalitis“ (Bestätigungskriterien) unterschieden. Durch die Wahl zu enger Eingangskriterien, die im zweiten Schritt insbesondere durch Auto-Antikörper-Nachweis zur „Bestätigung“ einer AE führen, könnte die Erkrankung einiger Patientinnen und Patienten nicht als Autoimmunenzephalitis eingestuft und diese Patientinnen und Patienten so erst mit zeitlicher Verzögerung oder gar nicht einer adäquaten Therapie zugeführt werden. Die Einschlusskriterien der GENERATE-Datenbank sind weiter gefasst, u.a. können auch Patientinnen und Patienten eingeschlossen werden, deren Erkrankung als autoimmun angesehen wird, weil sich die Symptomatik unter Immuntherapie gebessert hat. - Überprüfung der Diagnosekriterien von Graus et al. durch Vergleich der Patient/innen der GENERATE-Datenbank, die die Eingangs- bzw. Bestätigungskriterien von Graus et al. erfüllen, mit den Patienten der Datenbank, die lediglich die weiter gefassten Einschlusskriterien der Datenbank erfüllen. Identifikation möglicher Schwachpunkte der Kriterien von Graus et al..
Prof. Dr. med. Florian Then Berg (UK Leipzig)
Aufklärung der genetischen Veranlagung bei Autoimmunzephalitis
Das GENERATE Netzwerk hat 2017/18 die erste genomweite Assoziationsstudie (GWAS) Antikörpervermittelter Enzephalitiden der Subtypen NMDA und Lgi1 durchgeführt und publiziert (Müller et al. AnnNeurol (2018) 83:863:69). Dabei wurden in der sehr kleinen Stichprobe für den Subtyp Lgi1, neben einer sehr starken HLA-Assoziation weitere hoffnungsvolle Signale gefunden. Für den Subtyp NMDA wurde eine schwache Assoziation mit einem HLA-Haplotyp detektiert. Nun werden wir im Rahmen der BMFTR-Förderung eine zweite, wesentlich größere, genomweite Assoziationsstudie durchführen. Wie auch bei der letzten Publikation werden wir alle Ärzte/innen, die zu der Studie beitragen als Autoren/innen oder als Mitglieder von GENERATE in einem Supplement namentlich erwähnt. Eingeschlossen werden alle Patienten/innen, die für eine Teilnahme an GENERATE eingewilligt haben und von denen entweder EDTA-Blut/DNA vorliegt oder eine Speichelprobe zugänglich ist.
Prof. Dr. med. Gregor Kuhlenbäumer, Prof. Dr. Frank Leypoldt (UKSH Kiel)
Behandlung von AE: Eine multizentrische randomisierte, kontrollierte, doppelblinde Studie zur Bewertung der Wirksamkeit und Sicherheit von Bortezomib bei Patient/innen mit schwerer Autoimmunenzephalitis bei GENERATE (BOOST-GENERATE)
GENERATE-BOOST ist eine multizentrische, randomisierte, kontrollierte und doppelblinde Studie zur Überprüfung der Wirksamkeit und Sicherheit von Bortezomib bei Patienten/innen mit schwerer autoimmuner Enzephalitis. Es sollen insgesamt 50 Patientinnen und Patienten über einen Zeitraum von etwa zwei Jahren eingeschlossen werden. Die Randomisierung erfolgt 1:1 nach computerbasiertem Algorithmus, stratifiziert nach Prüfzentrum. Ziel der Studie ist zu prüfen, ob eine Behandlung von Patientinnen und Patienten mit Autoimmuner Enzephalitis mittels Bortezomib zu einer Verbesserung der Krankheitssymptome sowie zu einer Reduktion pathogener Antikörper-Titer führt. Die Studiendauer ist so veranschlagt, dass maximal 3 Zyklen Bortezomib verabreicht werden können (9 Wochen) und die Gesamtdauer der Studiendauer für jeden Patienten/in 17 Wochen beträgt. Die Studiendauer ist mit insgesamt 17 Wochen und 3 Zyklen Bortezomib ausreichend lange gewählt, dass eine klinische Besserung der schwer betroffenen Patientinnen und Patienten erfasst werden sollte.
Prof. Dr. Christian Geis, Prof. Dr. med. André Scherag (UK Jena), PD Dr. med. Harald Prüß (Charité Berlin)



