Wie werden neuronale Antikörper nachgewiesen?
Die Testung auf antineuronale Antikörper hat in den letzten Jahren an Möglichkeiten aber auch an Komplexität zugenommen. Wie jedes Testsystem können die verwendeten Testsysteme falsch-positive und falsch-negative Ergebnisse produzieren. Dieses Risiko lässt sich durch eine Reihe an Maßnahmen minimieren. Korrekt durchgeführt, ermöglicht der Nachweis antineuronaler Antikörper die Abgrenzung von Differentialdiagnosen, eine Prognoseabschätzung, Therapieempfehlung und leitet die Tumorsuche.
Testsysteme:
Grundsätzlich stehen als Testsysteme verschiedene teils komplementäre, teils unabhängige Systeme zur Verfügung (Abbildung 1):
- Gewebe-basierte Testsysteme (Abbildung 1A): Bei dieser Testung wird Hirngewebe von Nagern oder Primaten fixiert und ultra-dünn geschnitten und dann mit Patientenserum und/oder -liquor in Verdünnungen überschichtet. Die Darstellung der Bindung der humanen Antikörper erfolgt mit Fluoreszenz-markierten (nicht gezeigt) oder biotinylierten Antihuman-Antikörpern und enzymatischer Farbstoffreaktion. Bräunliche Abschnitte zeigen eine Bindung von humanen Antikörpern an. Dieser Test kann keine direkten Zielantigene nachweisen, sondern dient als Suchtest und ggs. Bestätigungstest für u.g. Verfahren.
- Zell-basierte Testsysteme (Abbildung 1B): Bei diesen werden humane Tumorzelllinien mit dem Zielantigen transfiziert und die Bindung von Antikörpern im Patientenserum und/oder -liquor mit einem anti-humanen, fluoreszenzmarkierten Antikörper markiert und meist unter einem Fluoreszenzmikroskop ausgewertet. Varianten existieren mit fixierten und unfixierten Zellen. Diese Testsysteme kommen bei konformationellen Antigenen zur Anwendung, d.h. bei Antigenen, die in ihrer natürlichen Umgebung und Konformation (Faltung) vorliegen müssen um vom Antikörper erkannt zu werden. Beispiele sind die meisten „synaptischen Antikörper“ NMDA Rezeptor-, AMPA Rezeptor, GABA(B) Rezeptor, LGI1-, CASPR2-Antikörper, etc.
- Immunoblots/Lineblots (Abbildung 1C): Bei diesen Testsystemen wird die Bindung an rekombinantes Antigen getestet, welches auf Membranen in „Linien“ fixiert wurde. Dieses Testverfahren hat sich zur Bestätigung von Antikörpern gegen intrazelluläre Antigene bewährt, z.B. Hu-, Yo-, CV2/CRMP5-, Amphiphysin-Antikörpern.
- Oberflächenfärbung von hippocampalen Primärkulturen (1D). Dieses Verfahren steht nur in einzelnen wissenschaftlichen Laboren zur Verfügung. Es dient der Lokalisation des Zielantigens auf der Oberfläche von Nervenzellen bei Seren/Liquores, die in Suchtestsystemen (1A) antineuronale Antikörper enthalten und deren Zielantigen mit spezifischen Testsystemen (1B) nicht identifiziert werden kann, so dass es sich um ein unbekanntes Zielantigen handeln könnte.
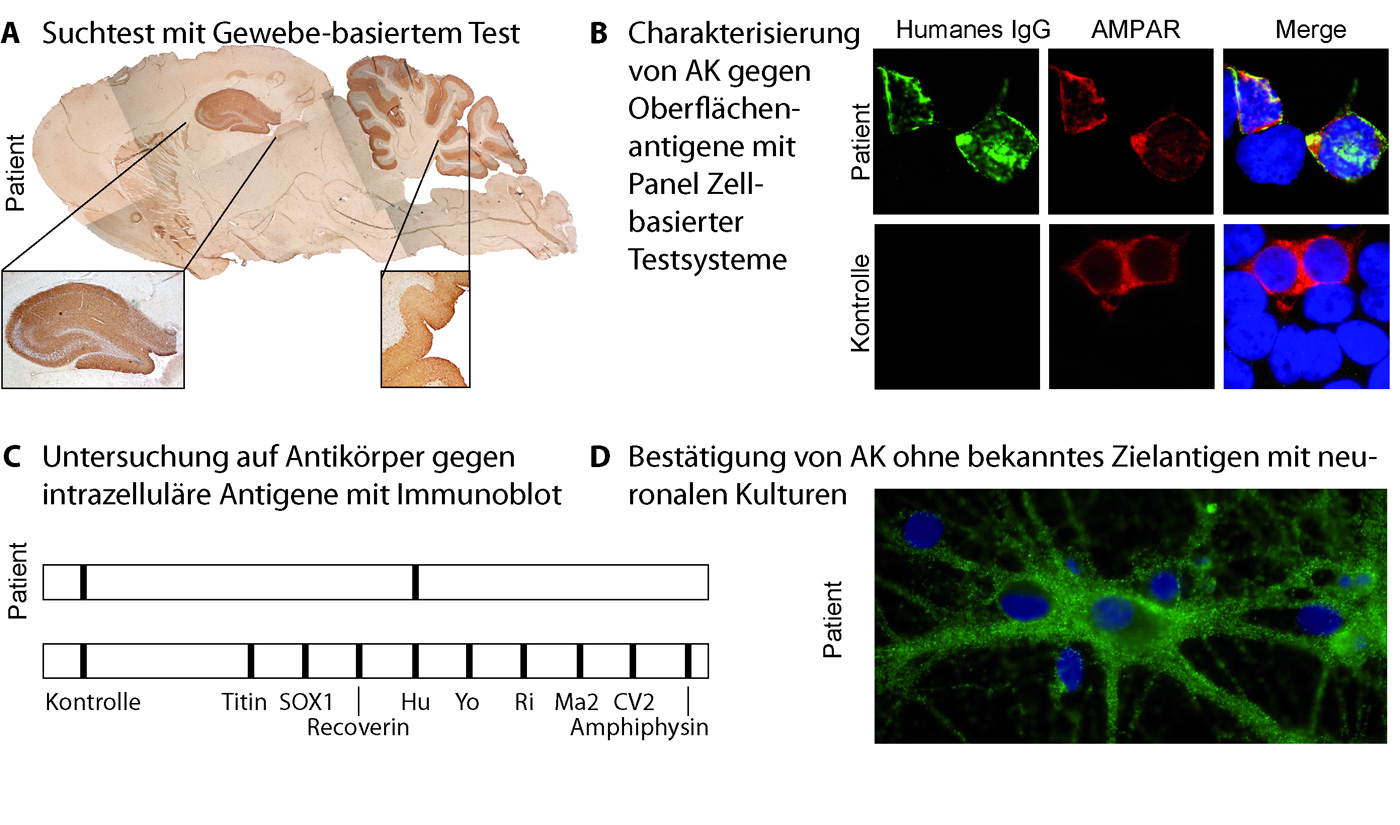
Abbildung 1: Testsysteme.
Wie im Text erklärt exemplarische Darstellung von Gewebebasierter Testung als Suchtest (A), Zell-basierter Testung als Bestätigungstest am Beispiel einer Probe mit AMPA Rezeptor Antikörpern (B, rot kommerzieller AMPA-Rezeptor Antikörper, grün anti-humaner IgG-Antikörper), Immunblot/Line Blot als Bestätigunstest für Antikörper gegen intrazelluläre Antigene (C) und Lokalisation des Zielantigens unbekannter Antikörper mithilfe von hippocampalen Primärkulturneuronen.
Interpretation:
Die Autoantikörpertestung hat unter Berücksichtigung einiger Besonderheiten eine sehr hohe diagnostische Sensitivität und Spezifität für den Nachweis der jeweiligen Enzephalitisform. Sie betragen für die anti-NMDA Rezeptor Enzephalitis: Spezifität 100%, Sensitivität 100% [98,5–100,0%]; für andere Enzephalitisunterformen sind diese Parameter weniger gut untersucht aber erfahrungsgemäß in einem ähnlichen Bereich. Nicht selten finden sich jedoch trotz aller Bemühungen bei klinisch wahrscheinlichen autoimmunen Enzephalitiden (Graus et al, 2016) keine nachweisbaren Autoantikörper. Daher liegt die Sensitivität auch einer umfassenden Antikörpertestung auf alle in Frage kommenden neuronalen Antikörper bei klinisch definierten, autoimmunen Enzephalitiden schätzungsweise bei 60-80%.
Bei der Testung sind einige Aspekte zu berücksichtigen:
(1) Bei einzelnen Unterformen ist die Untersuchung des Serums ohne begleitende Liquoruntersuchung deutlich weniger sensitiv und spezifisch [z. B. bei der Anti-NMDA-Rezeptor-Enzephalitis 16 % falsch negativ bei reiner Serumdiagnostik (Gresa-Arribas 2014)]. Wir empfehlen daher die parallele Antikörpertestung in Liquor- und Serumproben.
(2) Für den gezielten Nachweis der häufigsten Antikörper stehen standardisierte, kommerzielle Testsysteme zur Verfügung, bei denen rekombinante oder aufgereinigte, native Einzelantigene eingesetzt werden. Diese Untersuchungen werden in vielen Laboren angeboten. Aufgrund der Überlappung der Symptome zwischen den verschiedenen Krankheitsbildern kann die Diagnostik im Sinne eines Autoantikörper-Profils (Abbildung 2) unter Einbeziehung der bekannten Einzelantigene und neuronalen Gewebes daher Vorteile gegenüber einer Einzelantikörpertestung bieten. Diese Testung sollte jedoch aufgrund der Kosten gezielt eingesetzt werden.
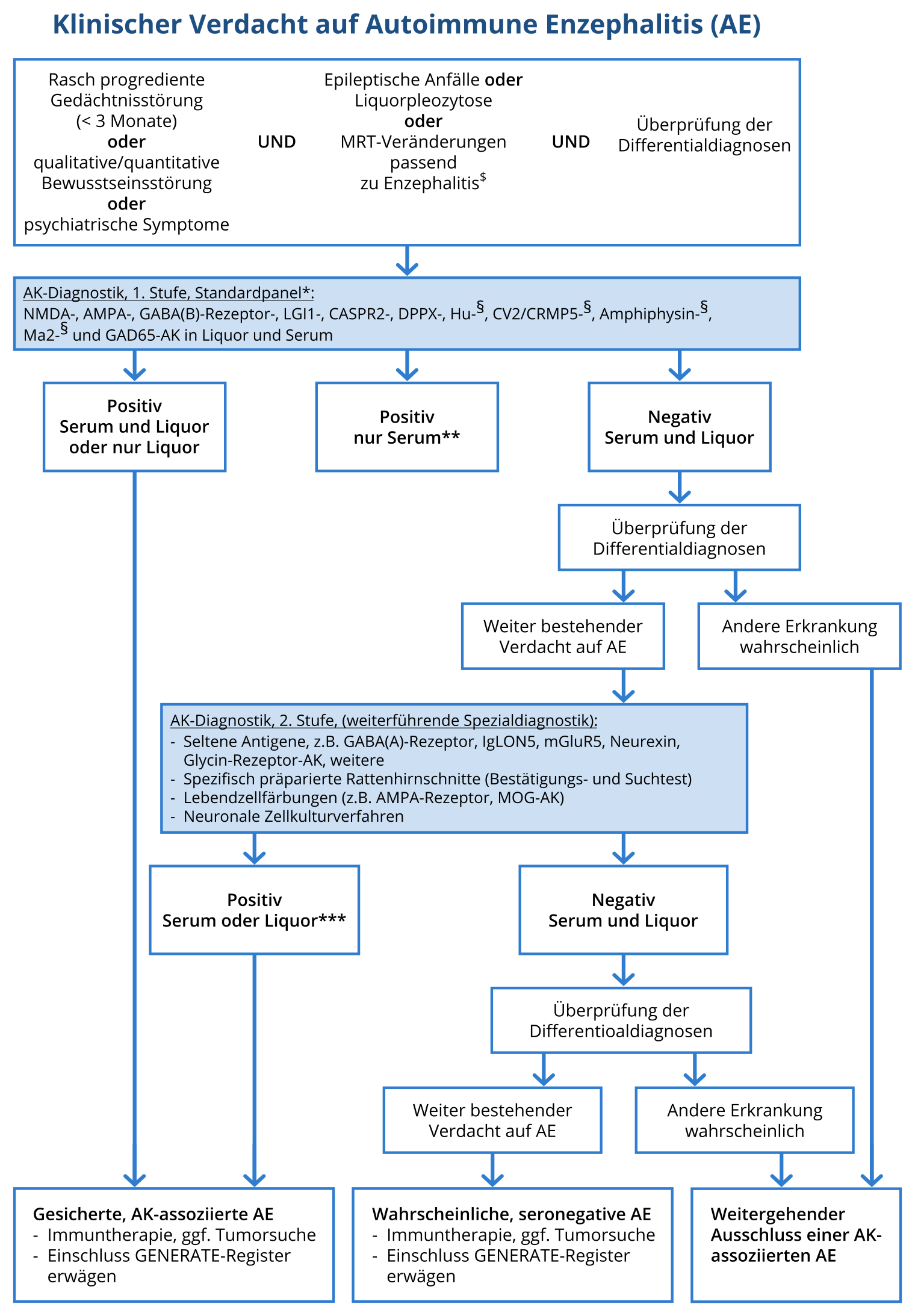
Abbildung 2: Vorgeschlagener Diagnosealgorithmus (modifiziert nach Wandinger, Leypoldt et al. Deutsches Ärzteblatt 2018
Vorgeschlagener Diagnosealgorithmus zur Untersuchung auf autoimmune Enzephalitiden. Basierend auf (Graus, 2016). *Standardisierte, kommerziell verfügbare Testsysteme (Immunfluoreszenz mit Gewebe und fixierten, transfizierten Zellen, ELISA, Immunoblot). **Immunfluoreszenzergebnisse mit Zell-basierten Kommerziellen Testsystemen mit niedrigen Titern (<1:40) ohne korrespondierende Ergebnisse im Liquor können falsch-positiv sein. $ Hinweisend auf eine Enzephalitis im MRT sind insbesondere beidseitige Ödeme des mittleren Schläfenlappens. Allerdings finden sich am häufigsten unspezifische Veränderungen und das MRT dient insbesondere der Differentialdiagnose.
(3) Bei der isolierten Untersuchung von Serum auf Antikörper gegen neuronale Oberflächenantigene mit diesen Testsystemen (transfizierte Zellen, sogenannte Zell-basierte Testsysteme) können falsch-positive Raten von 1 – 2 % auftreten. Daher sollte der Nachweis von antineuronalen Antikörpern bei Enzephalitissyndromen im Serum mit niedrigem Titer (< 1:40) ohne korrespondierenden Befund im Liquor kritisch gewertet und die Konstellation durch weiterführende Diagnostik in einem auf autoimmune Enzephalitiden spezialisierten Labor überprüft werden (Abbildung) (Graus, 2016).
(4) Die sicher mit Enzephalitiden assoziierten Autoantikörper gehören ggw. ausnahmslos der Immunglobulinklasse G an (Graus, 2016). Die diagnostische Wertigkeit antineuronaler Antikörper der Klassen IgA und IgM ist unklar. Beispielsweise wurden IgA- oder IgM-Antikörper gegen NMDA-Rezeptoren im Serum von bis zu 10% von Patienten mit unterschiedlichen neuropsychiatrischen Erkrankungen und, in gleicher Frequenz, von Gesunden nachgewiesen (Dahm 2014).
(5) Unter experimentell-wissenschaftlichen Untersuchungsbedingungen konnte bei Patienten mit Anti-NMDA-Rezeptor-Enzephalitis eine Korrelation zwischen Krankheitsaktivität und Antikörpertiter im Liquor nachgewiesen werden (Gresa-Arribas, 2014). Diese Beobachtung ließ sich jedoch nicht auf die Routinediagnostik übertragen, so dass Antikörperverläufe im klinischen Alltag keine Relevanz besitzen. Bei Patienten mit LGI1- und Anti-NMDA-Rezeptor-Enzephalitis wurde zudem eine Persistenz der jeweiligen Antikörper in der Remissionsphase beschrieben (Arino, 2016).
(6) Mit den gegenwärtig kommerziell verfügbaren Testsystemen lassen sich die häufigsten antineuronalen Antikörper nachweisen. Für viele seltenere Zielantigene existieren aber keine validierten Testsysteme. Es werden weiter außerdem zunehmend neue Zielantigene identifiziert. Diese diagnostische Lücke kann bei Patienten mit klinischem Verdacht auf eine autoimmune Enzephalitis mit speziellen immunhistochemischen Methoden geschlossen werden, die in der Regel nur in wissenschaftlichen Speziallaboratorien durchgeführt werden. Diese Untersuchungen, bei denen spezifisch und unter Schonung der Integrität von Membranproteinen präparierte Gewebeschnitte eingesetzt werden, stellen ein erweitertes Suchsystem für neue Antikörper dar und dienen gleichzeitig der Überprüfung und Bestätigung bekannter Antikörper. (Abbildung 1) (Dalmau 2011). Eine klinisch vermutete autoimmune Enzephalitis darf daher erst dann als seronegativ interpretiert werden, wenn auch dieser Gewebe-basierte Screeningtest keinen Nachweis einer antineuronalen Antikörperreaktivität erbringt (Graus 2016).
(7) Nicht selten lassen sich bei Patienten mit autoimmunen Enzephalitiden zusätzlich weitere systemische (z. B. ANA) oder organspezifische (z. B. anti-TPO) Autoantikörper nachweisen. Diese Befunde, die auf eine allgemeine autoimmune Diathese hinweisen, können in Unkenntnis der spezifischen antineuronalen Antikörper und Krankheitsbilder Anlass zu Fehldiagnosen geben (z. B. neuropsychiatrischer Lupus erythematodes, Hashimoto-Enzephalitis). Diese Erkrankungen sollten daher erst nach einer umfassenden Testung auf antineuronale Antikörper inklusive erweiterter serologischer Suchtests erwogen werden (Graus 2016).
Zusammenfassend erfordert die rationale Antikörperdiagnostik bei Patienten mit autoimmunen Enzephalitiden (a) allgemeine Kenntnis der klinischen Warnzeichen einer zugrundeliegenden autoimmunen Enzephalitis bei dem behandelnden Arzt, (b) einen klinik-internen Konsens oder ein laborseitig angebotenes Antikörperpanel zur standardisierten, syndromorientierten Antikörpertestung, (c) die Zusammenarbeit mit einem auf autoimmune Enzephalitiden spezialisierten Labor, welches geeignete Such- und Bestätigungstests für die entsprechenden Antikörper anbietet, (d) die enge Interaktion zwischen behandelndem Arzt und Labor bei atypischer Klinik und positiver Antikörperkonstellation, oder hohem klinischem Verdacht ohne Antikörpernachweis.
Literatur
- Ariño H, Armangue T, Petit-Pedrol M, Sabater L, Martinez-Hernandez E, Hara M, et al. Anti-LGI1-associated cognitive impairment: Presentation and long-term outcome. Neurology. 2016 Aug 23;87(8):759–65.
- Dahm L, Ott C, Steiner J, Stepniak B, Teegen B, Saschenbrecker S, et al. Seroprevalence of autoantibodies against brain antigens in health and disease. Annals of Neurology. 2014 Jul;76(1):82–94.
- Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon R. Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis. Lancet Neurol. 2011 Jan;10(1):63–74.
- Graus F, Titulaer MJ, Balu R, Benseler S, Bien CG, Cellucci T, et al. A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol. 2016 Apr;15(4):391–404.
- Gresa-Arribas N, Titulaer MJ, Torrents A, Aguilar E, McCracken L, Leypoldt F, et al. Antibody titres at diagnosis and during follow-up of anti-NMDA receptor encephalitis: a retrospective study. Lancet Neurol. 2014 Feb;13(2):167–77.
- Titulaer MJ, McCracken L, Gabilondo I, Armangue T, Glaser C, Iizuka T, et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol. 2013 Feb;12(2):157–65.